O control da cadea de distribución de medicamentos, desde a súa fabricación ou importación ata a súa dispensación, é un elemento indispensable para garantir a calidade dos medicamentos e avalar que as condicións de conservación, transporte e subministración son axeitadas.
Segundo o establecido no título IV da Lei 3/2019, do 2 de xullo, de ordenación farmacéutica de Galicia, a distribución dos medicamentos de uso humano autorizados realizarase a través das entidades de distribución ou directamente polo laboratorio titular da autorización da súa comercialización.
O artigo 63.1 desta lei indica que, de conformidade coa normativa básica estatal, as entidades de distribución de medicamentos de uso humano están sometidas a autorización previa ao seu funcionamento.
Para estes efectos, constitúen normativa básica estatal o texto refundido da Lei de garantías e uso racional dos medicamentos e produtos sanitarios aprobado polo Real decreto lexislativo 1/2015, do 24 de xullo, e o Real Decreto 782/2013, do 11 de outubro, sobre distribución de medicamentos de uso humano.
De acordo co artigo 1.2 do Real decreto 782/2013, do 11 de outubro, o termo «entidades de distribución de medicamentos» engloba as figuras dos almacéns grosistas de distribución (en diante, almacéns grosistas), dos almacéns por contrato e dos almacéns de medicamentos baixo control ou vixilancia aduaneira, das cales este decreto será de aplicación ás dúas primeiras.
O artigo 2 do mencionado texto refundido da Lei de garantías e uso racional dos medicamentos e produtos sanitarios define distribución grosista de medicamentos como «toda actividade que consista en obter, almacenar, conservar, subministrar ou exportar medicamentos, excluída a dispensación ao público destes» e, almacén por contrato, como a «entidade que actúa como terceiro, coa que un laboratorio ou un almacén grosista subscribe un contrato para realizar determinadas actividades de distribución de medicamentos».
Tanto os almacéns grosistas coma os almacéns por contrato estarán sometidos á autorización previa da comunidade autónoma onde estea domiciliado o almacén, como dispón o artigo 68 do mencionado texto refundido, por iso, e para os efectos da presente norma, aplicarase a ambas figuras o termo común de «entidades de distribución de medicamentos de uso humano».
Tamén requirirán autorización previa as modificacións relevantes que afecten os locais, equipamentos e actividades, de modificación das condicións autorizadas, de traslado a outras instalacións, a inclusión dun almacén por contrato na autorización dunha entidade de distribución de medicamentos de uso humano, así como o cesamento da súa actividade.
Para a obtención da autorización, as entidades de distribución deberán cumprir as exixencias de funcionamento establecidas na referida normativa.
Pola súa banda, os almacéns de distribución de medicamentos de uso humano que realicen as súas actividades nalgunha comunidade autónoma diferente á comunidade na que están domiciliados comunicarán a realización da actividade ás autoridades sanitarias das comunidades autónomas onde tales actividades se realicen, de conformidade co artigo 68.1 do texto refundido da Lei de garantías e uso racional dos medicamentos e produtos sanitarios. Así mesmo, deberán ser obxecto de comunicación os cambios de titularidade dunha entidade de distribución, tal e como exixe o artigo 63.5 da Lei 3/2019, do 2 de xullo.
No que se refire á Comunidade Autónoma de Galicia, correspóndelle á subdirección xeral con competencias en materia de Inspección de Servizos Sanitarios a competencia para tramitar estes procedementos, as funcións de planificación e coordinación das inspeccións de verificación do cumprimento das exixencias de funcionamento das entidades de distribución e das boas prácticas de distribución de medicamentos de uso humano, así como de elaboración da correspondente proposta de resolución das autorizacións de modificación, revogación e peche das entidades. Pola súa parte, a competencia para ditar as resolucións de autorización correspóndelle á Secretaría Xeral Técnica da Consellería de Sanidade.
Este decreto consta de 21 artigos que se corresponden aos seguintes aspectos: obxecto, ámbito de aplicación, requisitos das entidades de distribución de medicamentos, solicitudes e documentos. Regúlase a solicitude de autorización de inicio de actividade dunha entidade de distribución, así como de autorización de modificación relevante, de inclusión dun almacén por contrato na autorización dunha entidade de distribución de medicamentos de uso humano e de peche e as comunicacións de cambio de titularidade e de realización da actividade de distribución de medicamentos de uso humano por entidades de distribución autorizadas noutra comunidade autónoma. Recolle o relativo á comprobación de datos, á avaliación das solicitudes, á súa resolución e notificación, ao contido da autorización e a obriga de notificación á Agencia Española de Medicamentos y Productos Sanitarios e a outras comunidades autónomas. Tamén regula as causas de extinción das autorizacións e o réxime sancionador. Complétase cunha disposición adicional relativa á actualización de modelos normalizados e unha derradeira acerca da entrada en vigor.
O decreto tramitouse de conformidade co disposto na Lei 39/2015, do 1 de outubro, do procedemento administrativo común das administracións públicas, e na Lei 16/2010, do 17 de decembro, de organización e funcionamento da Administración xeral e do sector público autonómico de Galicia, sendo obxecto de publicación no Portal de transparencia e goberno aberto da Xunta de Galicia, sometida a audiencia dos grupos e sectores con dereitos e intereses lexítimos na materia. Así mesmo, foi sometida a informe económico-financeiro da consellería competente en materia de facenda, informe sobre impacto de xénero e informe da Asesoría Xurídica Xeral.
Finalmente, no exercicio da potestade regulamentaria, e para a mellora da calidade normativa, esta Administración actuou de conformidade cos principios de boa regulación, nomeadamente, os de necesidade, proporcionalidade, seguridade xurídica, transparencia, accesibilidade, simplicidade, eficacia e eficiencia, recollidos no artigo 37.1 da Lei 14/2013, do 26 de decembro, de racionalización do sector público autonómico, así como no artigo 129 da Lei 39/2015, do 1 de outubro.
Na súa virtude, por proposta do conselleiro de Sanidade, de acordo co Consello Consultivo e logo da deliberación do Consello da Xunta de Galicia, na súa reunión do día dezaseis de febreiro de dous mil vinte e tres,
DISPOÑO
Artigo 1. Obxecto
O obxecto do presente decreto é a regulación dos procedementos que a seguir se indican:
a) Autorización previa de funcionamento dunha entidade de distribución de medicamentos de uso humano (código de procedemento SA202A).
b) Autorización de modificación relevante dunha entidade de distribución de medicamentos de uso humano (código de procedemento SA202B).
c) Autorización de peche dunha entidade de distribución de medicamentos de uso humano (código de procedemento SA202C).
d) Comunicación de realización da actividade de distribución de medicamentos de uso humano por unha entidade de distribución que non estea domiciliada no territorio da Comunidade Autónoma de Galicia, pero que desenvolva nela a súa actividade (código de procedemento SA202D).
e) Comunicación do cambio de titularidade das entidades de distribución de medicamentos de uso humano (código de procedemento SA202E).
f) Autorización de inclusión dun almacén por contrato na autorización dunha entidade de distribución de medicamentos de uso humano (código de procedemento SA202F).
Artigo 2. Ámbito de aplicación
1. Este decreto será de aplicación ás seguintes entidades de distribución de medicamentos de uso humano domiciliadas na Comunidad Autónoma de Galicia, de acordo coas definicións recollidas no texto refundido da Lei de garantías e uso racional dos medicamentos e produtos sanitarios aprobado polo Real decreto lexislativo 1/2015, do 24 de xullo:
a) Os almacéns grosistas de distribución.
b) Os almacéns por contrato.
2. Os almacéns grosistas e os almacéns por contrato que non estean domiciliados na Comunidade Autónoma de Galicia, pero que desenvolvan nela a súa actividade están suxeitos á obriga de comunicar a súa actividade á consellería con competencias en materia de sanidade.
Artigo 3. Requisitos das entidades de distribución de medicamentos
1. As entidades de distribución de medicamentos, con carácter previo ao seu funcionamento, deberán dispoñer da correspondente autorización. Cada instalación dunha entidade de distribución de medicamentos require dunha autorización independente, polo que o traslado a outras instalacións require dunha nova autorización, de conformidade co procedemento regulado no artigo 5 e anexo I. Igualmente, deberán dispoñer de autorización para os supostos de modificacións relevantes que afecten os locais, equipamentos e actividades, de modificación das condicións autorizadas, de traslado a outras instalacións e de cesamento da súa actividade.
2. Para a concesión da autorización previa e as súas modificacións relevantes, as entidades de distribución de medicamentos deberán cumprir os requisitos materiais, persoais e de funcionamento previstos no capítulo II do Real Decreto 782/2013, do 11 de outubro, sobre distribución de medicamentos de uso humano.
Considérase modificación relevante para efectos deste decreto toda modificación das condicións autorizadas ou alteración substancial que afecte as instalacións ou as condicións de estrutura, seguridade ou solidez do local no que se sitúe a entidade; ampliación ou redución da súa superficie ou modificación que teña repercusión na actividade de distribución desenvolvida.
As autorizacións de modificacións relevantes deberán solicitarse de forma previa á súa realización efectiva.
3. Para obter a autorización de peche, a entidade de distribución autorizada deberá xustificar o motivo do dito peche. Este non debe comprometer, en ningún caso, a función prioritaria e esencial do conxunto da actividade de distribución de medicamentos, que é o abastecemento ás oficinas de farmacia e servizos de farmacia legalmente autorizados segundo as garantías recollidas no artigo 3 do Real decreto 782/2013, do 11 de outubro.
4. As entidades de distribución de medicamentos de uso humano que estean domiciliados noutra comunidade autónoma, pero que realicen actividades de distribución de medicamentos de uso humano en Galicia, deberán estar autorizadas como entidade de distribución pola autoridade sanitaria competente da comunidade autónoma onde teña a instalación de almacenamento e dispoñer dun certificado en vigor de cumprimento de boas prácticas de distribución de medicamentos de uso humano, de acordo coas directrices da Comisión Europea do 5 de novembro de 2013, sobre prácticas correctas de distribución de medicamentos para uso humano.
5. No suposto de que un almacén grosista utilice un almacén por contrato para a distribución de medicamentos deberá solicitar que se inclúa na súa autorización. Na solicitude, farase constar as actividades de distribución que o terceiro contratado vai realizar e deberá achegar o contrato asinado entre as partes.
6. Os cambios de titularidade das entidades de distribución de medicamentos deberán ser comunicados.
Artigo 4. Presentación de solicitudes e comunicacións
1. As solicitudes presentaranse obrigatoriamente por medios electrónicos a través do formulario normalizado dispoñible na sede electrónica da Xunta de Galicia, https://sede.xunta.gal, de acordo co seguinte:
a) A solicitude de autorización previa de funcionamento dunha entidade de distribución de medicamentos de uso humano presentarase utilizando o formulario normalizado que figura no anexo I.
b) A solicitude de modificación relevante dunha entidade de distribución de medicamentos de uso humano presentarase utilizando o formulario normalizado que figura no anexo II.
c) A solicitude de autorización de peche dunha entidade de distribución de medicamentos de uso humano deberá realizarse, con tres meses de antelación respecto da data prevista do peche, segundo o modelo recollido no anexo III.
d) A comunicación de realización da actividade de distribución de medicamentos de uso humano por unha entidade de distribución que non estea domiciliada no territorio da Comunidade Autónoma de Galicia pero que desenvolva nela a súa actividade, deberá realizarse segundo o modelo recollido no anexo IV.
e) A comunicación do cambio de titularidade das entidades de distribución de medicamentos de uso humano deberá realizarse segundo o modelo recollido no anexo V.
f) A solicitude de autorización de inclusión dun almacén por contrato na autorización dunha entidade de distribución de medicamentos de uso humano deberá realizarse segundo o modelo recollido no anexo VI.
2. De conformidade co artigo 68.4 da Lei 39/2015, do 1 de outubro, do procedemento administrativo común das administracións públicas, se algunha das persoas interesadas presenta a súa solicitude presencialmente, requiriráselle para que a emende a través da súa presentación electrónica. Para estes efectos, considerarase como data de presentación da solicitude aquela na que fose realizada a emenda.
3. Para a presentación electrónica poderá empregarse calquera dos mecanismos de identificación e sinatura admitidos pola sede electrónica da Xunta de Galicia, incluído o sistema de usuario e clave Chave365 (https://sede.xunta.gal/chave365).
Artigo 5. Procedemento de autorización previa de funcionamento dunha entidade de distribución de medicamentos de uso humano
A solicitude de autorización previa de funcionamento dunha entidade de distribución de medicamentos de uso humano (SA202A) deberá achegar a documentación que se especifica no anexo I; isto é:
a) Ámbito de autorización do almacén de distribución, segundo o anexo I.A.
b) Memoria técnica que incluirá:
1º. Descrición do sistema de garantía de calidade implantado na empresa en relación coas boas practicas de distribución de medicamentos de uso humano.
2º. Organigrama con descrición das funcións de todo o persoal.
3º. Definición dos procesos de todas as actividades que se van desenvolver.
4º. Relación de locais e equipos.
5º. Listaxe dos procedementos normalizados de traballo (xerais e específicos).
6º. Outra información de interese: horario de funcionamento, zona ou territorio que pretende abastecer, garantías de que a entrega de medicamentos se realiza exclusivamente en locais legalmente autorizados, sistema de garantía de continuidade de subministración e sistema que asegure que o transporte de medicamentos se fai en condicións adecuadas.
c) Declaración responsable relativa a que a persoa propietaria da entidade, ben sexa a título individual ou colectivo, non está incursa nalgunha causa de incompatibilidade co exercicio doutras actividades de carácter sanitario que supoñan intereses directos coa dispensación ou fabricación de medicamentos ou que vaia en detrimento do adecuado cumprimento das súas funcións, segundo o anexo I.B.
d) Documento de designación da persoa responsable para exercer a dirección técnica pola persoa responsable da entidade de distribución ou persoa facultada para iso, asinado por ambas.
e) Certificación académica da persoa designada para exercer a dirección técnica da entidade que acredite que a persoa reúne as condicións establecidas no artigo 6 do Real decreto 782/2013, do 11 de outubro, sobre distribución de medicamentos de uso humano.
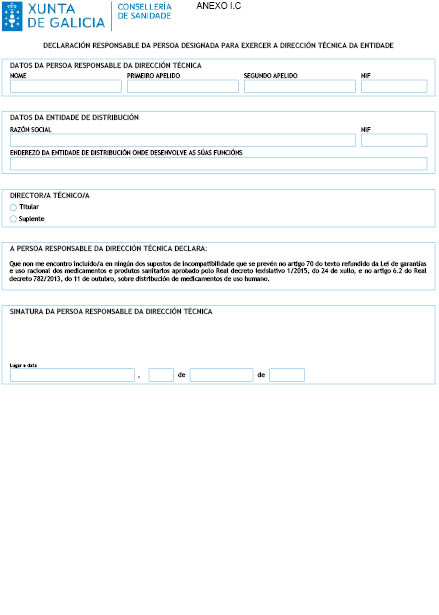
f) Declaración responsable da persoa designada para exercer a dirección técnica da entidade de non atoparse incursa nalgunha causa de incompatibilidade co exercicio doutras actividades de carácter sanitario que supoñan intereses directos coa dispensación ou fabricación de medicamentos ou que vaia en detrimento do axeitado cumprimento das súas funcións, tal e como establece o artigo 70 do texto refundido da Lei de garantías e uso racional dos medicamentos e produtos sanitarios aprobado polo de Real decreto lexislativo 1/2015, do 24 de xullo, e o artigo 6.2 do Real decreto 782/2013, do 11 de outubro (anexo I.C).
g) Certificado de colexiación ou documentación equivalente da persoa designada para exercer a dirección técnica da entidade.
h) Contrato de traballo ou certificado de vida laboral da persoa designada para exercer a dirección técnica da entidade.
i) Especificación da dedicación horaria da persoa designada para exercer a dirección técnica da entidade.
j) Acreditación da experiencia e formación da persoa designada para exercer a dirección técnica da entidade.
k) Certificación acreditativa da formación e experiencia en boas prácticas de distribución de medicamentos de uso humano da persoa designada para exercer a dirección técnica da entidade.
l) Plano/s das instalacións con identificación das diferentes zonas co detalle suficiente para permitir visualizar a localización do mobiliario e dos equipos.
m) Plano dos fluxos de persoal e medicamentos.
n) Plan mestre de validación de procesos e cualificación de equipos.
ñ) Relación das actividades contratadas e os contratos que correspondan.
o) Copia do contrato de servizos cunha empresa autorizada para realización de técnicas en desinfección, desinsectación e desratización (DDD).
p) Copia do contrato de servizos cunha empresa xestora de residuos, se procede.
q) Documento acreditativo do aboamento das taxas 31.11.03 «Autorización de funcionamento ou traslado de entidade de distribución de medicamentos de uso humano» e 31.11.07 «Inspección para a verificación do cumprimento de boas prácticas de distribución de medicamentos de uso humano e/ou de boas prácticas de distribución de principios activos para medicamentos de uso humano».
r) Documentación acreditativa do representante legal.
s) Escritura de constitución da entidade solicitante, debidamente inscrita no rexistro correspondente.
Artigo 6. Procedemento de modificación relevante dunha entidade de distribución de medicamentos de uso humano
A solicitude de autorización de modificación relevante dunha entidade de distribución de medicamentos de uso humano (SA202B) deberá achegar a documentación que se especifica no anexo II, en función do tipo de modificación que se solicita, isto é:
a) Carta de solicitude na que consten os detalles da modificación solicitada.
b) Ámbito da autorización do almacén de distribución, no caso que se solicite cambio do ámbito (anexo II.A).
c) Memoria técnica actualizada coa información pertinente relativa aos cambios solicitados e que, polo menos, incluirá: descrición do sistema de garantía de calidade implantado na empresa en relación coas boas prácticas de distribución de medicamentos de uso humano; organigrama con descrición das funcións de todo o persoal; definición dos procesos de todas as actividades que se vaian desenvolver; relación de locais e equipos; listaxe dos procedementos normalizados de traballo (xerais e específicos) e outra información de interese: horario de funcionamento, zona ou territorio que pretende abastecer, garantías de que a entrega de medicamentos se realiza exclusivamente en locais legalmente autorizados, sistema de garantía de continuidade de subministración e sistema que asegure que o transporte de medicamentos se fai en condicións adecuadas.
d) No caso de cambio da persoa designada para exercer a dirección técnica da entidade de distribución:
1º. Designación da persoa responsable para exercer a dirección técnica pola persoa responsable da entidade de distribución ou persoa facultada para iso, asinada por ambos.
2º. Certificación académica da persoa designada para exercer a dirección técnica da entidade que acredite que a persoa reúne as condicións establecidas no artigo 6 do Real decreto 782/2013, do 11 de outubro.
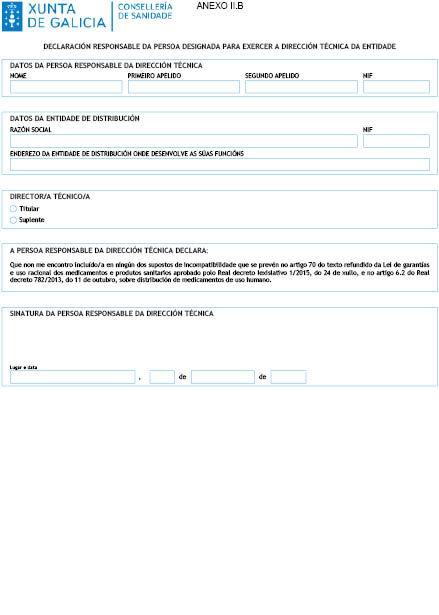
3º. Declaración responsable da persoa designada para exercer a dirección técnica da entidade de non atoparse incursa nalgunha causa de incompatibilidade co exercicio doutras actividades de carácter sanitario que supoñan intereses directos coa dispensación ou fabricación de medicamentos ou que vaia en detrimento do axeitado cumprimento das súas funcións, tal e como establece o artigo 70 do texto refundido da Lei de garantías e uso racional de medicamentos e produtos sanitarios aprobado polo Real decreto lexislativo 1/2015, do 24 de xullo, e o artigo 6.2 do Real decreto 782/2013, do 11 de outubro (anexo II.B).
4º. Certificado de colexiación ou documentación equivalente da persoa designada para exercer a dirección técnica da entidade.
5º. Contrato de traballo ou certificado de vida laboral da persoa designada para exercer a dirección técnica da entidade.
6º. Especificación da dedicación horaria da persoa designada para exercer a dirección técnica da entidade.
7º. Acreditación da experiencia e formación da persoa designada para exercer a dirección técnica da entidade.
8º. Certificación acreditativa da formación e experiencia en boas prácticas de distribución da persoa designada para exercer a dirección técnica da entidade.
e) Documento acreditativo do abono das taxas correspondentes segundo o cambio. Taxa 31.11.04 «Autorización de modificacións relevantes que afecten aos locais, equipos ou actividades de entidades de distribución de medicamentos de uso humano».
f) Outra documentación que considere pertinente en relación ao cambio solicitado.
g) Documentación acreditativa do representante legal.
Artigo 7. Procedemento de autorización de peche dunha entidade de distribución de medicamentos de uso humano
A solicitude de autorización de peche dunha entidade de distribución de medicamentos de uso humano (SA202C) deberá achegar a documentación que se especifica no anexo III; isto é:
a) Plan do peche que describa o destino da documentación e medicamentos existentes no momento do peche da entidade.
b) Descrición do modo e período de conservación da documentación da entidade de distribución xerada durante o tempo que estivo autorizada e con actividade.
c) Documentación acreditativa do aboamento das taxas 31.11.06.
d) Documentación acreditativa do representante legal.
Artigo 8. Comunicación dunha entidade de distribución de medicamentos de uso humano que non estea domiciliada no territorio da Comunidade Autónoma de Galicia, pero que desenvolva nela a súa actividade
A comunicación dunha entidade de distribución de medicamentos de uso humano que non estea domiciliada no territorio da Comunidade Autónoma de Galicia, pero que desenvolva nela a súa actividade (SA202D) deberá achegar a documentación que se especifica no anexo IV; isto é:
a) Autorización de entidade de distribución emitida pola autoridade sanitaria competente da comunidade autónoma onde estea domiciliada a entidade.
b) Certificado de boas prácticas de distribución de medicamentos de uso humano en vigor emitido pola autoridade sanitaria competente.
c) Relación das actividades desenvolvidas pola entidade de distribución na Comunidade Autónoma de Galicia.
d) Memoria técnica actualizada da entidade de distribución na que, entre outros, se describa o sistema de garantía de calidade implantado na empresa en relación coas boas prácticas de distribución de medicamentos de uso humano, a zona ou concellos de Galicia que pretende abastecer, garantías de que a entrega de medicamentos se realiza exclusivamente en locais legalmente autorizados e a clientes legalmente establecidos e sistema que asegure que o transporte de medicamentos se fai nas condicións autorizadas de conservación dos medicamentos.
e) Documentación acreditativa do representante legal.
Artigo 9. Comunicación do cambio de titularidade das entidades de distribución de medicamentos de uso humano
A comunicación do cambio de titularidade das entidades de distribución de medicamentos de uso humano (SA202E) deberá achegar a documentación que se especifica no anexo V; isto é:
a) Documento válido en dereito acreditativo da transmisión da titularidade da entidade de distribución de medicamentos.
b) Documento acreditativo do aboamento da taxa 31.11.05 «Autorización de cambio de titularidade dunha entidade de distribución de medicamentos de uso humano».
c) Documentación acreditativa do representante legal.
d) Escritura da constitución da sociedade comunicante.
Artigo 10. Procedemento de autorización de inclusión dun almacén por contrato na autorización dunha entidade de distribución de medicamentos de uso humano
A solicitude de autorización de inclusión dun almacén por contrato na autorización dunha entidade de distribución de medicamentos de uso humano (SA202F) deberá achegar a documentación que se especifica no anexo VI; isto é:
a) Carta de solicitude na que consten as actividades contratadas ao almacén por contrato proposto para ser incluído na autorización da entidade de distribución solicitante.
b) Copia do contrato entre a entidade de distribución solicitante e o almacén contratado.
c) Autorización do almacén por contrato emitida pola autoridade sanitaria competente.
d) Certificado de boas prácticas de distribución de medicamentos de uso humano en vigor emitido pola autoridade sanitaria competente.
e) Documento acreditativo do aboamento das taxas correspondentes segundo o cambio. Taxa 31.11.04 «Autorización de modificacións relevantes que afecten os locais, equipos ou actividades de entidades de distribución de medicamentos de uso humano».
f) Outra documentación que se considere pertinente.
g) Documentación acreditativa do representante legal.
Artigo 11. Presentación da documentación complementaria
1. A documentación complementaria deberá presentarse electronicamente.
Se algunha das persoas interesadas presenta a documentación complementaria presencialmente, requiriráselle para que a emende a través da súa presentación electrónica. Para estes efectos, considerarase como data de presentación aquela na que fose realizada a emenda.
As persoas interesadas responsabilizaranse da veracidade dos documentos que presenten. Excepcionalmente, cando a relevancia do documento no procedemento o exixa ou existan dúbidas derivadas da calidade da copia, a Administración poderá solicitar de maneira motivada o cotexo das copias achegadas pola persoa interesada, para o que poderán requirir a exhibición do documento ou da información orixinal.
2. Sempre que se realice a presentación de documentos separadamente da solicitude, deberase indicar o código e o órgano responsable do procedemento, o número de rexistro de entrada da solicitude e o número de expediente se se dispón del.
3. No caso de que algún dos documentos que hai que presentar de forma electrónica superase os tamaños máximos establecidos ou tivese un formato non admitido pola sede electrónica da Xunta de Galicia, permitirase a presentación deste de forma presencial dentro dos prazos previstos e na forma indicada no número anterior. A información actualizada sobre o tamaño máximo e os formatos admitidos pode consultarse na sede electrónica da Xunta de Galicia.
4. De conformidade co artigo 28.3 da Lei 39/2015, do 1 de outubro, do procedemento administrativo común das administracións públicas, non será necesario achegar os documentos que xa fosen presentados anteriormente pola persoa interesada ante calquera Administración. Neste caso, a persoa interesada deberá indicar en que momento e ante que órgano administrativo presentou os ditos documentos, que serán recadados electronicamente a través das redes corporativas ou mediante consulta ás plataformas de intermediación de datos ou outros sistemas electrónicos habilitados para efecto, agás que conste no procedemento a oposición expresa da persoa interesada.
De forma excepcional, se non se puidesen obter os citados documentos, poderá solicitarse novamente á persoa interesada a súa achega.
Artigo 12. Comprobación de datos
1. Para a tramitación destes procedementos consultaranse automaticamente os datos incluídos nos seguintes documentos en poder da Administración actuante ou elaborados polas administracións públicas, agás que a persoa interesada se opoña á súa consulta:
a) NIF da entidade solicitante ou comunicante.
b) DNI/NIE da persoa representante da entidade.
2. No caso de que as persoas interesadas se opoñan á consulta, deberán indicalo no recadro correspondente habilitado no formulario e achegar os documentos.
Cando así o esixa a normativa aplicable, solicitarase o consentimento expreso da persoa interesada para realizar a consulta.
3. Excepcionalmente, no caso de que algunha circunstancia imposibilitase a obtención dos citados datos, poderase solicitar ás persoas interesadas a presentación dos documentos correspondentes.
Artigo 13. Emendas das solicitudes e comunicacións
O órgano competente en materia de inspección de servizos sanitarios comprobará que as solicitudes e as comunicacións reúnen todos os requisitos exixidos. Se unha solicitude ou unha comunicación non estivese debidamente cuberta ou non se achegase a documentación exixida, requirirase á entidade interesada para que, de conformidade co disposto no artigo 68 da Lei 39/2015, do 1 de outubro, emende a falta ou achegue os documentos preceptivos nun prazo máximo de dez (10) días hábiles con indicación de que, de non facelo así, se terá por desistido da súa solicitude ou comunicación e se procederá conforme o establecido no dito artigo.
Artigo 14. Trámites administrativos posteriores á presentación da solicitude ou comunicación
Todos os trámites administrativos que as persoas interesadas deban realizar tras a presentación da solicitude ou comunicación deberán ser efectuados electronicamente accedendo á Carpeta cidadá da persoa interesada dispoñible na sede electrónica da Xunta de Galicia.
Artigo 15. Avaliación das solicitudes
1. O órgano competente para a instrución dos procedementos será a subdirección xeral con competencias en materia de inspección de servizos sanitarios.
2. Durante a instrución realizaranse de oficio cantas actuacións se consideren necesarias para determinar, coñecer e comprobar os datos que deben motivar a proposta de resolución, incluída a correspondente visita de inspección á entidade.
3. Unha vez realizadas as comprobacións e as visitas de inspección pertinentes, o persoal inspector elaborará un informe proposta no que cualificará o cumprimento de requisitos como favorable ou desfavorable para a concesión da autorización correspondente.
Artigo 16. Resolución
1. Finalizada a fase de instrución do procedemento, a persoa titular da Secretaría Xeral Técnica da consellería con competencia en materia de sanidade ditará a correspondente resolución de autorización.
2. O prazo máximo para notificar a resolución dos procedementos de autorización previa de funcionamento da instalación dunha entidade de distribución, de peche e de modificación relevante será de noventa (90) días hábiles, a partir da data de entrada na sede electrónica da solicitude, coa excepción do procedemento de autorización de inclusión dun almacén por contrato na autorización dunha entidade de distribución que será de trinta días hábiles. Transcorrido este prazo sen terse notificada a resolución ao solicitante, entenderase estimada a solicitude.
3. Contra a resolución ditada, as persoas interesadas poderán interpoñer recurso de alzada ante a persoa titular da consellería competente en materia de sanidade no prazo dun mes contado a partir do día seguinte ao da notificación da resolución, de acordo co disposto nos artigos 121 e 122 da Lei 39/2015, do 1 de outubro.
Artigo 17. Notificación
1. As notificacións de resolucións e actos administrativos practicaranse só por medios electrónicos, nos termos previstos na normativa reguladora do procedemento administrativo común.
2. De conformidade co artigo 45.2 da Lei 4/2019, do 17 de xullo, de administración dixital de Galicia, as notificacións electrónicas practicaranse mediante a comparecencia na sede electrónica da Xunta de Galicia e a través do Sistema de notificación electrónica de Galicia-Notifica.gal. Este sistema remitirá ás persoas interesadas avisos da posta á disposición das notificacións á conta de correo e/ou teléfono móbil que consten na solicitude. Estes avisos non terán, en ningún caso, efectos de notificación practicada e a súa falta non impedirá que a notificación sexa considerada plenamente válida.
3. De conformidade co artigo 47 da Lei 4/2019, do 17 de xullo, as persoas interesadas deberán crear e manter o seu enderezo electrónico habilitado único a través do Sistema de notificación electrónica de Galicia-Notifica.gal, para todos os procedementos administrativos tramitados pola Administración xeral e as entidades instrumentais do sector público autonómico. En todo caso, a Administración xeral e as entidades do sector público autonómico de Galicia poderán de oficio crear o indicado enderezo, para os efectos de asegurar o cumprimento polas persoas interesadas da súa obriga de relacionarse por medios electrónicos.
4. As notificacións entenderanse practicadas no momento no que se produza o acceso ao seu contido, entendéndose rexeitada cando transcorresen dez (10) días naturais desde a posta á disposición da notificación sen que se acceda ao seu contido.
5. Se o envío da notificación electrónica non fose posible por problemas técnicos practicarase a notificación polos medios previstos na normativa reguladora do procedemento administrativo común.
Artigo 18. Contido da autorización
O contido da autorización das entidades de distribucións atenderá ao formato consensuado pola Comisión Europea.
Artigo 19. Notificación á Agencia Española de Medicamentos y Productos Sanitarios e a outras comunidades autónomas
1. Toda autorización relativa a unha entidade de distribución, calquera modificación que a afecte, así como a súa suspensión e revogación serán notificadas á Agencia Española de Medicamentos y Productos Sanitarios coa finalidade de manter actualizado o catálogo de entidades de distribución, así como o cumprimento do intercambio de información establecido na normativa europea.
2. O órgano da Administración xeral da Comunidade Autónoma de Galicia con competencias en materia de inspección de servizos sanitarios comunicará a inclusión dun almacén por contrato na autorización dun almacén grosista á comunidade autónoma onde estea situado o citado almacén por contrato.
Artigo 20. Causas de extinción das autorizacións
1. As autorizacións das entidades de distribución de medicamentos de uso humano extínguense pola desaparición da personalidade xurídica do titular da entidade de distribución, así como polo peche definitivo da entidade de distribución de conformidade co disposto no Real decreto 782/2013, do 11 de outubro.
2. Toda alteración das condicións tidas en conta para a concesión da autorización poderá dar lugar á revogación da autorización da entidade de distribución.
Así mesmo, as autorizacións outorgadas ás entidades de distribución perderán a súa validez e serán revogadas se, unha vez transcorrido un ano desde o seu outorgamento, se comproba que a entidade non desenvolve de forma plena, efectiva e continuada todas as actividades de distribución para as cales foi autorizada.
O órgano competente en materia de inspección de servizos sanitarios, logo da tramitación de expediente con audiencia da entidade interesada, ditará no prazo de tres meses resolución de revogación contra a que cabe recurso en vía administrativa.
Artigo 21. Réxime sancionador
O incumprimento das condicións e requisitos establecidos neste decreto serán sancionados de acordo co establecido na Lei 3/2019, do 2 de xullo, de ordenación farmacéutica de Galicia, e no texto refundido da Lei de garantías e uso racional dos medicamentos e produtos sanitarios, aprobado polo Real decreto lexislativo 1/2015, do 24 de xullo.
Disposición adicional única. Actualización de modelos normalizados
De conformidade coa disposición adicional sexta da Lei 4/2019, do 17 de xullo, os modelos normalizados aplicables na tramitación dos procedementos regulados nesta disposición, poderán ser actualizados co fin de mantelos adaptados á normativa vixente. Para estes efectos será suficiente a publicación dos modelos actualizados na sede electrónica da Xunta de Galicia, onde estarán permanentemente accesibles para todas as persoas interesadas, sen que sexa necesaria unha nova publicación no Diario Oficial de Galicia.
Disposición derradeira única. Entrada en vigor
O presente decreto entrará en vigor aos vinte (20) días da súa publicación no Diario Oficial de Galicia.
Santiago de Compostela, dezaseis de febreiro de dous mil vinte e tres
Alfonso Rueda Valenzuela
Presidente
Julio García Comesaña
Conselleiro de Sanidade